Sanidad actualiza los criterios de los nuevos antivirales del covid. Consúltalos aquí
covid
La situación epidemiológica pcn respecto al covid es ahora menos compleja y hay disponibilidad de diferentes tratamientos frente a la enfermedad que ya están comercializados y, en algunos casos, incluso se han adquirido a través de compras centralizadas europeas.
Por ello, la intervención y priorización de tratamientos por parte de la AEMPS ya no es necesaria. Corresponde al médico, dentro de la práctica clínica habitual, decidir la opción más adecuada atendiendo a las características y especificidades de su paciente, de acuerdo a la ficha técnica o las instrucciones de los distintos comités sanitarios a nivel autonómico u hospitalario.
Para el uso de los medicamentos en inmunización pasiva se deben seguir las recomendaciones emitidas por Salud Publica, a través de la ponencia de vacunas. En el caso de Evusheld, la Comisión de Salud Pública actualizó las recomendaciones de utilización para la prevención de COVID-19 el 15 de diciembre de 2022
Mientras existía disponibilidad limitada de las nuevas alternativas terapéuticas antivirales frente al covid-19, la AEMPS desarrolló unos criterios para valorar la administración de estas alternativas. junto con un grupo técnico de expertos formado por representantes de sociedades científicas y de comunidades autónomas. En aras de la transparencia, y aunque ya no sean necesarios, se mantienen publicados estos “Criterios para valorar la administración de las nuevas alternativas terapéuticas antivirales frente a la infección por SARS-CoV-2”
En estos momentos hay una limitada disponibilidad de las nuevas alternativas terapéuticas antivirales frente a la infección por SARS-CoV-2. Esto hace necesario establecer unos criterios de priorización en el acceso precoz a los mismos.
Las alternativas disponibles que se consideran en este documento son (Anexo I).
- Veklury (remdesivir)
- Paxlovid (nirmatrelvir/ritonavir)
- Lagevrio (molnupiravir)
- Ronapreve (casirivimab / imdevimab)
- Xevudy (sotrovimab)
- Evusheld (cilgavimab /tixagevimab)
La accesibilidad a los tratamientos disponibles se ha priorizado considerando aspectos como la gravedad y/o el riesgo de complicaciones, la respuesta a los tratamientos disponibles y el beneficio esperable.
Algunos de los tratamientos indicados en este documento son moléculas de nuevo desarrollo y otros son medicamentos ya autorizados. De todos ellos se genera constantemente nueva información, que debe ser analizada conforme está disponible para la toma de decisiones por las agencias reguladoras. Además, es necesario actualizar e informar del procedimiento establecido para que se pueda acceder a los medicamentos disponibles. Es por ello que este documento está sometido a actualizaciones continúas conforme se disponga de nuevas evidencias científicas, según la evolución de la epidemia y según la evolución de los stocks de medicamentos disponibles. La AEMPS cuenta para ello, con un grupo de expertos formado por representantes de sociedades científicas y de comunidades autónomas (Anexo II).
La Agencia recomienda a los profesionales sanitarios que consulten las fichas técnicas de los medicamentos que estén autorizados en lo relativo a las recomendaciones de dosis, advertencias y precauciones, posibles reacciones adversas e interacciones.
El acceso a estos medicamentos se realizará por los cauces habituales, en el caso de Evusheld, la distribución se realizará por los cauces ya establecidos. En aquellas CC. AA. que no dispongan de un depósito estratégico de anticuerpos monoclonales (Xevudy, Ronapreve), así como aquellas que lo indiquen expresamente, la solicitud de acceso individual para cada paciente se podrá hacer a través del portal de medicamentos en situaciones especiales (MSE) de la AEMPS. En la mayoría de los hospitales, esa solicitud se gestiona telemáticamente desde el Servicio de Farmacia a partir de la indicación del médico y el visto bueno de la dirección médica (que en algunos hospitales puede no ser requerido de forma individual en las condiciones de priorización descritas a continuación). La gestión debe realizarse de forma inmediata tras la indicación médica y la respuesta de la AEMPS se debe recibir en 24 horas.
En el caso de Paxlovid, debido al perfil de interacciones y advertencias especiales de uso, se requiere una validación farmacéutica previa a su dispensación. Este circuito de validación lo establecerá cada CC.AA. y debe ser inferior a 24h. En el caso de pacientes privados y pertenecientes a MUFACE, MUGEJU e ISFAS con asistencia sanitaria privada, el acceso a Paxlovid se tramitará a través de MSE.
En el caso de los anticuerpos monoclonales, siempre que sea posible, se debe discriminar previamente cual es la variante que está produciendo la infección. La decisión sobre el uso de anticuerpos monoclonales debe tener en cuenta lo que se conoce sobre las características de los virus del SARS-CoV-2 circulantes y la información disponible sobre los patrones de sensibilidad a los mismos.
Se recomienda consultar la última información disponible al respecto:
En el caso de los anticuerpos monoclonales, estos han mostrado una mayor eficacia en pacientes con serología negativa. Por tanto, es necesario determinar el estado serológico antes de su prescripción. Con el objetivo de incorporar más pacientes que se puedan beneficiar del tratamiento con anticuerpos monoclonales se ha considerado que los pacientes con un bajo nivel de protección también pueden beneficiarse de este tratamiento.
Hasta ahora se ha establecido que si el título de anticuerpos frente a la proteína S es menor de 260 BAU/ml se considera una respuesta inadecuada a la vacunación. Este umbral se estableció a partir de un estudio realizado en el contexto de la cepa original de Wuhan, al igual que las instrucciones de uso del Panel Internacional de Normas de Referencias de la OMS para anticuerpos anti-SARS-CoV que se establecieron en diciembre 2020. Hasta la fecha no se ha validado el nuevo umbral frente a las diferentes variantes de interés, por lo que actualmente este umbral se puede considerar orientativo e indicativo de una pobre respuesta a la vacunación. Por otro lado, para demostrar una respuesta adecuada sólida a la vacunación sería necesario disponer de serologías seriadas que aseguraran el mantenimiento en el tiempo de la respuesta inmune lo cual no es posible desde el punto de vista práctico.
Por todo ello, además de valorar la cuantificación de los títulos de anticuerpos frente a la proteína S, se propone tener en cuenta el grado de inmunosupresión del paciente. Es decir, la interpretación del resultado de la serología tendrá que llevarse a cabo junto con las características del paciente en cuanto a su grado de inmunosupresión y el riesgo individual de infección.
La decisión de considerar a la población elegible para este tratamiento tiene que basarse prioritariamente en los resultados de serología (anticuerpos frente a proteína S).
Se recuerda la importancia de notificar todas las sospechas de reacciones adversas al Centro Autonómico de Farmacovigilancia correspondiente o a través del formulario electrónico disponible en www.notificaram.es
Criterios
La intención del documento es identificar criterios de priorización para el acceso precoz a las nuevas alternativas terapéuticas antivirales considerando su disponibilidad limitada. No debe ser considerada en ningún caso como una recomendación de uso por parte de la Agencia.
El acceso y utilización de los medicamentos ya disponibles en sus indicaciones autorizadas debe realizarse siguiendo los protocolos de manejo clínico de cada hospital.
Adultos o adolescentes mayores de 12 años con >40kg de peso hospitalizados por COVID-19 grave o crítico que presente serología negativa para SARS-CoV-2, o con bajo nivel de protección para SARS-CoV-2.
En este contexto, el tratamiento con anticuerpos monoclonales se restringe a los pacientes con las condiciones de alto riesgo descritas más adelante (Condiciones de alto riesgo priorizadas).
Debido a la gravedad de los pacientes, no es necesario considerar una ventana de inicio del tratamiento. Se seleccionará el anticuerpo monoclonal (Ronapreve, Xevudy o Evusheld) en función de la disponibilidad, situación epidemiológica local y actividad in vitro. Siempre que sea posible, se debe identificar la variante y tener en cuenta los datos más recientes disponibles.
En ambos casos, se trata de una indicación del medicamento no autorizada.
Estos pacientes, siempre y cuando presenten las condiciones de alto riesgo descritas en el presente documento, pueden ser candidatos tanto a anticuerpos monoclonales (Ronapreve, Xevudy o Evusheld) como a antivirales (Remdesivir, Paxlovid, Lagevrio).
Sin embargo, por su eficacia, facilidad de acceso y uso, se considera que la primera opción terapéutica recomendada es Paxlovid (nirmatrelvir/ritonavir) en pauta de 5 días. Se debe iniciar tratamiento dentro de los 5 días de evolución. Se resalta la importancia de valorar previamente interacciones farmacológicas.
En el caso de los pacientes incluidos en el apartado 1 que no sean candidatos a Paxlovid, si se dispone de resultado serológico que muestre que no hay respuesta a la vacunación (serología negativa o nivel de protección bajo) puede considerarse la administración de anticuerpos monoclonales.
En el resto de los casos (apartado 1 si no se dispone de serología o se ha confirmado una respuesta positiva a la vacuna, así como los apartados 2, 3 y 4), se puede considerar como alternativa el uso de:
- Veklury (remdesivir) en pauta de 3 días. Se debe iniciar tratamiento dentro de los 7 días de evolución.
- Lagevrio (molnupiravir), en pauta de 5 días. Iniciar tratamiento dentro de los 5 días de evolución.
En el paciente de alto riesgo con enfermedad leve-moderada, tanto los anticuerpos monoclonales como los antivirales se utilizarán de acuerdo a las condiciones de la ficha técnica autorizada.
El uso de Paxlovid en los pacientes con replicación viral persistente sintomáticos debe valorarse de manera individualizada por el centro hospitalario y en consenso con la Comunidad Autónoma.
Consideraciones en el paciente pediátrico
De entre las nuevas alternativas para el tratamiento de la infección por SARS-CoV-2 contenidas en el este documento, la opción terapéutica elegible para pacientes menores de 12 años, basado en la evidencia disponible, debería ser remdesivir. Debería considerarse su uso en pacientes menores de 12 años con los criterios de riesgo descritos en este documento, que presenten sintomatología respiratoria leve/moderada motivada por el COVID-19, con alto riesgo de empeoramiento de su infección viral, en el contexto de su vulnerabilidad de base. En los casos de hallazgo de COVID-19 en un contexto clínico sin los criterios previos, de aparición nosocomial sin sintomatología respiratoria, se deberá monitorizar la posible evolución de la infección viral con una determinación seriada de PCR y evolución del número de ciclos.
En caso de agravamiento posterior de un caso, tras remdesivir debería valorarse la utilización de líneas terapéuticas diferentes de los anticuerpos monoclonales, con mayor evidencia que estos en el momento actual.
Condiciones de alto riesgo priorizadas en adultos
1. Personas inmunocomprometidas y con otras condiciones de alto riesgo, independientemente del estado de vacunación:
- Receptores de trasplante de progenitores hematopoyéticos o CAR-T, en los dos años tras el trasplante/tratamiento, en tratamiento inmunosupresor o que tengan EICH independientemente del tiempo desde el TPH.
- Receptores de trasplante de órgano sólido (menos de dos años o sometido a tratamiento inmunosupresor por sospecha de rechazo activo con independencia del tiempo desde el trasplante).
- Tratamiento sustitutivo renal (hemodiálisis y diálisis peritoneal).
- Inmunodeficiencias primarias: combinadas y de células B en las que se haya demostrado ausencia de respuesta vacunal.
- Tratamiento activo con quimioterapia mielotóxica para enfermedades oncológicas o hematológicas. Se excluye el uso de hormonoterapia, inhibidores de checkpoint inmunes u otros tratamientos que no condicionan aumento en el riesgo de infección (por ejemplo, anticuerpos monoclonales antidiana no mielotóxicos).
- Pacientes con tratamientos onco-hematológicos no citotóxicos con neutropenia (< 500 neutrófilos/mcL) o linfopenia (< 1000 linfocitos/mcL) en el momento de la infección.
- Infección por VIH con ≤200 cel/ml (analítica en los últimos 6 meses).
- Fibrosis quística.
- Síndrome de Down con 40 o más años de edad (nacidos en 1981 o antes).
- Tratamiento inmunosupresor con corticoides orales a altas dosis o durante tiempo prolongado y ciertos inmunomoduladores no biológicos-Tratamiento con corticoides orales a altas dosis de manera continuada (equivalente a ≥20 mg/día de prednisolona durante 10 o más días consecutivos en los treinta días previos).
- Tratamiento prolongado con corticoides orales a dosis moderadas (equivalente a ≥10 mg/día de prednisolona durante más de cuatro semanas consecutivas en los treinta días previos)
- Altas dosis de corticoides orales (equivalente a >40mg/día de prednisolona durante más de una semana) por cualquier motivo en los treinta días previos
- Tratamiento en los tres meses anteriores con alguno de los siguientes fármacos inmunomoduladores no biológicos: metotrexato (>20 mg/semana o >15 mg/m2/sem, oral o subcutáneo), leflunomida, 6 mercaptopurina (>1,5 mg/kg/día) o azatioprina (>3 mg/kg/día), ciclosporina, micofenolato, tacrolimus (formas orales), sirolimus y everolimus en los tres meses previos.
-Anticuerpos monoclonales anti CD20
- Inhibidores de la proliferación de células B (inmunomoduladores dirigidos a marcadores de las células B como CD40, CD19, CD38, CD79, Bcl6 entre otros)
- Proteínas de fusión supresoras de linfocitos T (inmunomoduladores dirigidos a proteínas de fusión que supriman la proliferación de los linfocitos T como el antígeno CD152 o CTLA4 entre otros)
- Inhibidores de la interleukina 1 (IL-1)
- Anticuerpos monoclonales anti-CD52
- Moduladores del receptor de la esfingosina-1-fosfato
- Inhibidores de la proteinquinasa.
- Inhibidores de la familia janus quinasa (JAK)
2. Personas no vacunadas* con >80 años.
3. Personas no vacunadas* con >65 años y con al menos un factor de riesgo para progresión**.
4. Personas vacunadas (> 6 meses) con > 65 años y con al menos un factor de riesgo para progresión**.
* Se consideran personas no vacunadas las persones que no han recibido la pauta de vacunación completa (incluidas las dosis de recuerdo) y no han padecido la enfermedad en los 3 últimos meses.
** Se consideran factores de riesgo de progresión:
- Enfermedad renal crónica: Pacientes con tasa de filtración glomerular inferior a 60 ml/min.
- Enfermedad hepática crónica: pacientes con una clasificación en la escala de Child-Pugh para gravedad de la enfermedad hepática de clase B o C (enfermedad hepática descompensada).
- Enfermedad neurológica crónica (Esclerosis múltiple, esclerosis lateral amiotrófica, miastenia gravis o enfermedad de Huntington).
- Enfermedades cardiovasculares, definidas como antecedentes de cualquiera de los siguientes: infarto de miocardio, accidente cerebrovascular (ACV), accidente isquémico transitorio (AIR), insuficiencia cardíaca, angina de pecho con nitroglicerina prescrita, injertos de revascularización coronaria, intervención coronaria percutánea, endarterectomía carotídea y derivación aórtica.
- Enfermedad pulmonar crónica (EPOC de alto riesgo (FEV1 postbroncodilatación < 50% o disnea (mMRC) de 2-4 o 2 o más exacerbaciones en el último año o 1 ingreso); asma con requerimiento de tratamiento diario).
- Diabetes con afectación de órgano diana.
- Obesidad (IMC≥35).
- Bajo peso (IMC≤18,5).
Condiciones de alto riesgo priorizadas en niños (hasta 18 años)
- Receptores de trasplante alogénico de progenitores hematopoyéticos o CAR-T, en los dos años tras el trasplante/tratamiento, en tratamiento inmunosupresor o que tengan EICH independientemente del tiempo desde el TPH.
- Inmunodeficiencias primarias: combinadas y de células B en las que se haya demostrado ausencia de respuesta vacunal.
- Tratamiento inmunosupresor con inmunomoduladores biológicos: Personas que han recibido en los tres meses anteriores (seis meses en caso de rituximab): fármacos anti CD20 o belimumab. Considerar en caso que el paciente haya estado en tratamiento con corticoides prolongados a dosis altas (> 2 mg/kg/dia 14 días o más, > 1 mg/Kg/día 28 días o más, > 20 mg/día en niños de más de 10 kg de peso 14 días o más).
- Pacientes que reciben quimioterapia de alta intensidad para tratamiento de leucemia, y aquellos con recuentos muy bajos de linfocitios (<100 cells/µL),
- Patología crónica compleja con dependencia tecnológica respiratoria.
- Receptores de trasplante de órgano sólido (menos de dos años) Solo si altamente inmunodeprimidos (eventos de rechazo, inducción) o comorbilidad (obesidad, no vacunados).
- Fibrosis quística (solo si afectación pulmonar grave).
- Considerar en adolescentes obesos IMC > 35 sin vacunar.
Diagrama de los criterios para valorar la administración de las nuevas alternativas terapéuticas antivirales frente a la infección por SARS-CoV-2
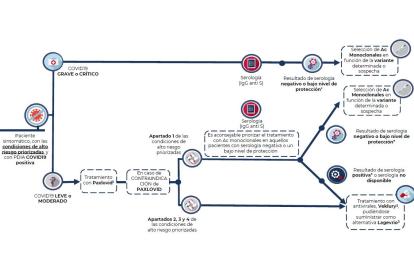
1. Paxlovid (nirmatrelvir/ritonavir): Se debe iniciar tratamiento dentro de los 5 días de evolución. 2. Veklury (remdesivir): .Se debe iniciar tratamiento dentro de los 7 días de evolución. 3. Lagevrio (molnupiravir): Se debe iniciar tratamiento dentro de los 5 días de evolución. * Bajo nivel de protección: Además de valorar la cuantificación de los títulos de anticuerpos frente a la proteína S, se debe tener en cuenta el grado de inmunosupresión del paciente. Es decir, la interpretación del resultado de la serología tendrá que llevarse a cabo junto con las características del paciente en cuanto a su grado de inmunosupresión y el riesgo individual de infección.
Tratamientos disponibles
Autorizados
Ronapreve (Casirivimab/imdevimab)
Evusheld (cilgavimab / tixagevimab)
Paxlovid (nirmatrelvir/ritonavir) No autorizados que cuentan con recomendación de uso del Comité de Medicamentos de Uso Humano
Lagevrio (Molnupiravir) Anexo II Grupo de Trabajo Técnico
Asociaciones de Profesionales y Sociedades Científicas
Expertos de las comunidades autónomas y Administración General del Estado
Coordinación del Grupo de Trabajo y del documento
1 National Institute for Biological Standards and Control. First WHO International Reference Panel for anti-SARS-CoV-2 immunoglobulin. NIBSC code: 20/268. Instructions for use (version 3·0). Potters Bar: National Institute for Biological Standards and Control, 2020.
2 Nature Medicine volume 27, pages2032–2040 (2021)
3 Gilbert et al., Science 375, 43–50 (2022)
4 Goldblatt et al. Vaccine 40 (2022) 306–315